衡陽(yáng)市中心醫(yī)院倫理審查資料遞交流程指引及最新附件下載
2025年5月1日起實(shí)行
總流程概述:
1���、A 編輯本次遞交資料的共享EXCEL目錄(【金山文檔 | WPS云文檔】 衡陽(yáng)市中心醫(yī)院倫理目錄2025.5.1 https://kdocs.cn/l/cpmJaESesNOM) —— 2��、將本次遞交資料簽字蓋章后交由C保管/同時(shí)掃描本次資料打包微信發(fā)倫理秘書(shū)(注意文件及文件夾序號(hào)命名規(guī)則?���。?/span>(無(wú)需遞交紙質(zhì)版!)—— 3�、倫理秘書(shū)將本次審查電子資料OA流轉(zhuǎn)至主審會(huì)審/快速審查、主委簽發(fā)批件后通知 C 領(lǐng)取遞交信回執(zhí)及批件原件(若為“備案”則倫理秘書(shū)將遞交信回執(zhí)電子版發(fā)送A及C) ——— 4�、C 將遞交信回執(zhí)、主審表����、批件原件連同本次遞交資料整理至文件夾(文件夾整理參照初始審查文件),待結(jié)題后一次性歸檔至倫理����?�!?nbsp;5����、會(huì)審及快審費(fèi)用支付并將打款憑證發(fā)倫理秘書(shū)獲取發(fā)票—— 6���、結(jié)束�。
流程詳細(xì)介紹:
一�、初始審查
總流程:在機(jī)構(gòu)同意立項(xiàng)審批簽字后(一)在共享表格編輯完成本次遞交資料目錄→(二)掃描版資料打包微信發(fā)至倫理秘書(shū)審核(初始審查可暫用未簽字蓋章版,后續(xù)馬上替換簽字蓋章版)→(三)秘書(shū)審核通過(guò)后準(zhǔn)備上會(huì)工作(倫理會(huì)審費(fèi)用支付��、郵寄15份精簡(jiǎn)版資料�、遞交初始審查匯報(bào)PPT)→(四)確定最終上會(huì)時(shí)間并召開(kāi)會(huì)議→(五)會(huì)前或會(huì)后5個(gè)工作日內(nèi)遞交初審紙質(zhì)資料供檢查→(六)會(huì)后5個(gè)工作日內(nèi)領(lǐng)取批件。
具體說(shuō)明:
(一)在共享表格編輯完成本次遞交資料目錄
根據(jù)倫理秘書(shū)指引加入“衡陽(yáng)市中心醫(yī)院倫理信息共享群”在群公告處找到“衡陽(yáng)市中心醫(yī)院倫理目錄”(【金山文檔 | WPS云文檔】 衡陽(yáng)市中心醫(yī)院倫理目錄2025.5.1
https://kdocs.cn/l/cpmJaESesNOM)���,根據(jù)參考模板編輯本項(xiàng)目初始審查遞交資料目錄(可直接復(fù)制粘貼參考模板中“初始審查”部分,然后修改版本號(hào)版本日期等)�。
(二)掃描版資料打包微信發(fā)至倫理秘書(shū)審核
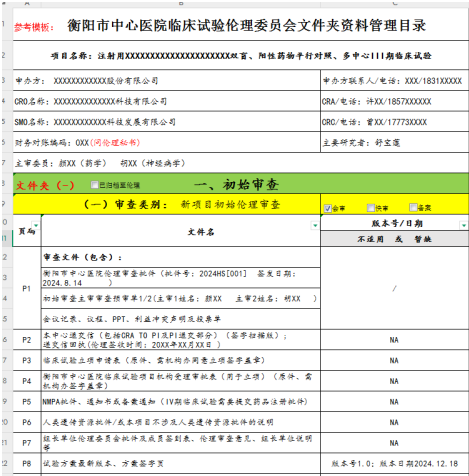
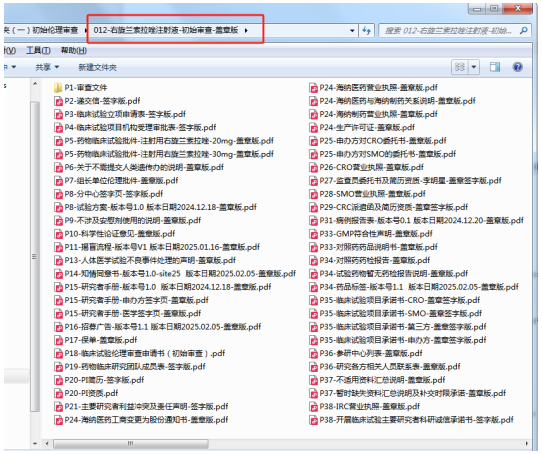
1、目錄編輯好后找倫理秘書(shū)確認(rèn)�����。對(duì)照已經(jīng)編輯好的目錄,(特別注意:文件必須和目錄一一對(duì)應(yīng)?����。?/span>文件根據(jù)頁(yè)碼(P)進(jìn)行排序命名(示例如下圖)��,文件格式為掃描版PDF(遞交信回執(zhí)部分為Word版)����。(特殊情況為避免來(lái)回簽字蓋章的麻煩,此次遞交電子版資料可暫無(wú)簽字蓋章�����,待倫理秘書(shū)審核通過(guò)后再替換簽字蓋章版)���。
2��、文件命名規(guī)則請(qǐng)嚴(yán)格按照“頁(yè)碼-文件名-版本號(hào)/版本日期”【示例:P14-知情同意書(shū)-版本號(hào)V1.0-site25/版本日期2025.02.05)��;文件夾命名規(guī)則請(qǐng)嚴(yán)格按照“項(xiàng)目財(cái)務(wù)編號(hào)-項(xiàng)目名稱(chēng)簡(jiǎn)稱(chēng)-審查類(lèi)別”(示例:012-XXX注射液-初審)���。
3、通過(guò)壓縮包形式微信發(fā)送倫理秘書(shū)�����。
(三)秘書(shū)審核通過(guò)后準(zhǔn)備上會(huì)工作(倫理會(huì)審費(fèi)用支付、郵寄15份精簡(jiǎn)版資料�、遞交初始審查匯報(bào)PPT)
倫理費(fèi)用支付
倫理審查收費(fèi)標(biāo)準(zhǔn):(1)會(huì)議審查倫理審查費(fèi)為4800元/(次*項(xiàng))(不含稅);(目前稅費(fèi)為6%�����。總額=4800+288稅費(fèi)=5088元)���。(2)快速審查倫理審查費(fèi)為1600元/(次*項(xiàng))(不含稅)�����;(目前稅費(fèi)為6% ����。總額=1600+96=1696元)����。(3)會(huì)前3-5個(gè)工作日的緊急申請(qǐng),收取規(guī)定費(fèi)用2倍的加急審查費(fèi)�����;(4)會(huì)前1-2個(gè)工作日內(nèi)的申請(qǐng)�,須經(jīng)主任委員簽字審批,并收取規(guī)定費(fèi)用5倍的加急審查����;(5)說(shuō)明:如,同一財(cái)務(wù)編號(hào)001的項(xiàng)目先后兩次遞交的申請(qǐng)算作兩次倫理審查�;不同財(cái)務(wù)編號(hào)001、002項(xiàng)目申請(qǐng)同一天會(huì)議審查算兩項(xiàng)���。(6)打款需備注:項(xiàng)目財(cái)務(wù)編號(hào)-項(xiàng)目名稱(chēng)簡(jiǎn)介-用途(詳見(jiàn)以下打款備注)
打款賬戶(hù)相關(guān)事宜
(1) 倫理審查費(fèi)以匯款形式交至醫(yī)院財(cái)務(wù)部���,匯款請(qǐng)注明XXX(院內(nèi)財(cái)務(wù)編碼)項(xiàng)目XXX倫理審查費(fèi);(具體備注:初審審查備注財(cái)務(wù)編碼-項(xiàng)目簡(jiǎn)稱(chēng)-初審���,跟蹤審查打款備注詳見(jiàn)以下“跟蹤審查”)
(2)醫(yī)院財(cái)務(wù)科倫理費(fèi)接收賬號(hào)等信息如下:
名 稱(chēng):衡陽(yáng)市中心醫(yī)院
賬 號(hào):4388 9999 1010 0030 49567
開(kāi) 戶(hù) 行:交通銀行衡陽(yáng)分行營(yíng)業(yè)部
統(tǒng)一社會(huì)信用代碼(稅號(hào))1243 0040 4454 3051 3H
(3)醫(yī)院財(cái)務(wù)部開(kāi)具正式發(fā)票�,申請(qǐng)者憑繳費(fèi)憑證領(lǐng)取發(fā)票���。
(4)具體倫理審查費(fèi)用參照醫(yī)院最新標(biāo)準(zhǔn)�����。
郵寄15份精簡(jiǎn)版資料
(1)國(guó)家局批件相關(guān)��;(2)試驗(yàn)方案���;(3)知情同意書(shū)�;(4)研究者手冊(cè)����;(5)招募廣告;(6)保險(xiǎn)相關(guān)����。
以上資料精簡(jiǎn)版資料裝訂并首頁(yè)形成目錄,制定側(cè)標(biāo)簽供翻閱�,共15份,圖示如下:請(qǐng)于會(huì)議當(dāng)天帶到會(huì)議室供委員會(huì)議現(xiàn)場(chǎng)翻閱����,會(huì)議結(jié)束后申辦方自行寄回。

遞交初始審查PPT
由 PI PPT匯報(bào),限時(shí)10分鐘����,PPT統(tǒng)一用本中心模板,經(jīng)PI確認(rèn)無(wú)誤后交倫理委員會(huì)秘書(shū)審核���,匯報(bào)當(dāng)天申辦方代表或CRA到場(chǎng)�����。PPT模板見(jiàn)附件.
(五)會(huì)前或會(huì)后3個(gè)工作日內(nèi)遞交初審紙質(zhì)資料
1�、對(duì)應(yīng)目錄整理好已簽字蓋章版紙質(zhì)資料遞交倫理委員會(huì)秘書(shū)�����,一式一份�。以下資料每項(xiàng)目共準(zhǔn)備3套置CRC處供跟蹤審查紙質(zhì)資料歸檔備用。資料內(nèi)容約滿50頁(yè)換下一文件夾��,通常初始審查(含初審后復(fù)審)為文件夾(一)����,跟蹤審查為文件夾(二)、(三)�����。
2�����、紙質(zhì)資料遞交時(shí)間:初始審查在會(huì)議審查前或會(huì)后3個(gè)工作日內(nèi);跟蹤審查無(wú)需馬上遞交紙質(zhì)資料(只需電子資料)����,審查結(jié)束后CRA郵寄至CRC處,CRC負(fù)責(zé)按目錄整理歸檔至CRC文件柜暫存���,結(jié)題后統(tǒng)一歸檔跟蹤審查資料文件夾至倫理秘書(shū)處�!
(1)文件夾要求:黑色���;兩孔(間距為80mm);尺寸為315mm × 280mm × 75mm��;示例見(jiàn)下圖��。推薦網(wǎng)址(【淘寶】100%買(mǎi)家好評(píng) http://e.tb.cn/h.gCEpAcZMNYCfRlb?tk=279k3MDxg5W MF3543 「得力快勞夾打孔文件夾活頁(yè)穿孔快勞夾資料冊(cè)收納整理夾A4雙孔加厚合同插頁(yè)快勞活頁(yè)資料試卷打洞可拆卸夾夾板」
點(diǎn)擊鏈接直接打開(kāi) 或者 淘寶搜索直接打開(kāi))

(2)制作好文件夾側(cè)面標(biāo)簽��,標(biāo)簽內(nèi)容包含項(xiàng)目名稱(chēng)�、NMPA等內(nèi)容����,(示例如圖,模版見(jiàn)以下壓縮包附件):

(3)每個(gè)文件夾準(zhǔn)備50張分頁(yè)紙(對(duì)應(yīng)序號(hào)1-50����。)推薦網(wǎng)址:【淘寶】100%買(mǎi)家好評(píng) http://e.tb.cn/h.gyrKnHok2xWChgX?tk=oF0s3MxXvxw CZ3456 「a4活頁(yè)隔頁(yè)紙數(shù)字12頁(yè)月度索引紙50頁(yè)標(biāo)簽11孔31頁(yè)彩色字母分類(lèi)紙20頁(yè)灰色多頁(yè)塑料分類(lèi)卡多功能檔案分頁(yè)紙」點(diǎn)擊鏈接直接打開(kāi) 或者 淘寶搜索直接打開(kāi) ����,示例如下:

(4)紙質(zhì)版資料裝訂順序示例:

二�����、跟蹤審查
總流程:(一)在共享表格根據(jù)模板編輯完成本次遞交資料目錄→(一)掃描版資料微信打包發(fā)倫理秘書(shū)審核→(二)秘書(shū)審核通過(guò)后支付費(fèi)用并將打款憑證發(fā)倫理秘書(shū)(跟蹤審查一般為快審或備案)���、安排主審審查(或安排備案)→(五)倫理秘書(shū)將批件、主審表���、遞交信回執(zhí)電子版反饋至CRC ����,批件原件保存在倫理秘書(shū)處→(六)CRC及時(shí)歸檔本次紙質(zhì)資料暫存至CRC文件柜����。(紙質(zhì)資料無(wú)需逐次遞交,待結(jié)題歸檔后一次性遞交?�。����?��!)
具體說(shuō)明:
(一)在共享表格編輯完成本次遞交資料目錄
根據(jù)倫理秘書(shū)指引加入“衡陽(yáng)市中心醫(yī)院倫理信息共享群”在群公告處找到“衡陽(yáng)市中心醫(yī)院倫理目錄”(【金山文檔 | WPS云文檔】 衡陽(yáng)市中心醫(yī)院倫理目錄2025.5.1
https://kdocs.cn/l/cpmJaESesNOM),根據(jù)參考模板編輯本次遞交資料目錄(可直接復(fù)制粘貼參考模板中相應(yīng)部分���,然后修改版本號(hào)版本日期等)�����。
(二)掃描版資料打包微信發(fā)至倫理秘書(shū)審核
1�����、目錄編輯好后找倫理秘書(shū)確認(rèn)��。對(duì)照已經(jīng)編輯好的目錄�,文件根據(jù)頁(yè)碼(P)進(jìn)行排序命名�。
2、文件命名規(guī)則請(qǐng)嚴(yán)格按照“頁(yè)碼-文件名-版本號(hào)/版本日期”【示例:P14-知情同意書(shū)-版本號(hào)1.0-site25 版本日期2025.02.05】��;文件夾命名規(guī)則請(qǐng)嚴(yán)格按照“項(xiàng)目財(cái)務(wù)編號(hào)-項(xiàng)目名稱(chēng)簡(jiǎn)稱(chēng)-(序號(hào))審查類(lèi)別”【示例:012-XXX注射液-(五)SAE(SC21006B白細(xì)胞增多首次)】���。
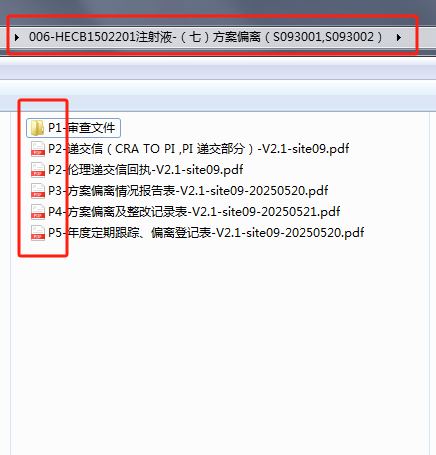
3�、完成如上文件及文件夾命后通過(guò)壓縮包形式微信發(fā)送倫理秘書(shū)審核�����。紙質(zhì)版資料裝訂規(guī)則參考初始審查。
(六)CRC及時(shí)歸檔本次紙質(zhì)資料暫存至CRC文件柜
1�、跟蹤審查無(wú)需遞交紙質(zhì)資料(只需電子資料)(紙質(zhì)資料無(wú)需逐次遞交!����!,待結(jié)題歸檔后一次性遞交?���。���?!)����,CRA將資料打孔寄至CRC處歸檔暫存CRC文件柜,歸檔要求詳見(jiàn)附件“倫理資料存檔規(guī)范檢查表”�����。若無(wú)省級(jí)檢查等特殊情況�����,只需結(jié)題后歸檔時(shí)統(tǒng)一遞交跟蹤審查資料文件夾(一)、(二)�����、(三)至倫理秘書(shū)處�!
2、紙質(zhì)資料歸檔規(guī)則參照“初始審查資料歸檔規(guī)則”����。(倫理秘書(shū)將定期抽查CRC紙質(zhì)資料暫歸檔情況)
跟蹤審查遞交資料清單(包括但不限于)如下:
跟蹤類(lèi)型 | 遞交資料清單 | 注意事項(xiàng) | 打款備注 |
復(fù)審 | 1審查文件:復(fù)審審查主審工作表(Word版!) | 模板請(qǐng)前往官網(wǎng)“文件下載”處下載���;填好表頭�,只需遞交Word電子版本����。 |
XXX-試驗(yàn)藥品名稱(chēng)簡(jiǎn)稱(chēng)-復(fù)審審查費(fèi)
示例:015-HECB21003注射液-復(fù)審審查費(fèi) |
2 本中心遞交信(包括CRA TO PI及PI遞交部分)(簽字掃描版); +遞交信回執(zhí)(Word版!?���。。?/span>
| 遞交資料簡(jiǎn)述處:注明各項(xiàng)資料版本號(hào)更新情況�����。 示例:方案V1.0-V2.0;知情.... |
| 復(fù)審申請(qǐng)表 |
|
倫理初始意見(jiàn)回復(fù)函
|
|
修訂后知情同意書(shū)
|
|
| 知情同意書(shū)修訂痕跡版 |
|
知情同意書(shū)修訂說(shuō)明
|
|
| 其他..... |
|
修正案 | 1審查文件:修正案審查主審工作表(Word版!?�?���!) | 模板請(qǐng)前往官網(wǎng)“文件下載”處下載;填好表頭�����,只需遞交Word電子版本�。 | XXX-試驗(yàn)藥品名稱(chēng)簡(jiǎn)稱(chēng)-修正案審查費(fèi)(方案、知情版本號(hào)變化簡(jiǎn)述)����。 示例:015-HECB21003注射液-修正案審查(方案V1.0-V2.0;知情...) 其中015(XXX)為項(xiàng)目院內(nèi)財(cái)務(wù)編號(hào) |
2 本中心遞交信(包括CRA TO PI及PI遞交部分)(簽字掃描版); +遞交信回執(zhí)(Word版?�。?/span>
| 遞交資料簡(jiǎn)述處:注明各項(xiàng)資料版本號(hào)更新情況��。 示例:方案V1.0-V2.0;知情.... |
3 修正案審查申請(qǐng)表 | 模板請(qǐng)前往官網(wǎng)“文件下載”處下載 |
4 組長(zhǎng)單位批件 |
|
5 修訂記錄(修正前后對(duì)比) | 包含版本號(hào)編號(hào)對(duì)比��、修訂前后內(nèi)容對(duì)比����、修訂原因�,以表格形式呈現(xiàn)��。 |
6 修訂痕跡版 |
|
7 修訂后版本 |
|
8 其他...... |
|
本院SAE(含首次�����、隨訪+總結(jié)) | 1審查文件:嚴(yán)重不良事件審查主審工作表(Word版)或非預(yù)期不良事件審查(Word版��!) | 模板請(qǐng)前往官網(wǎng)“文件下載”處下載�����;填好表頭�,只需遞交Word電子版本。 | XXX-試驗(yàn)藥品名稱(chēng)簡(jiǎn)稱(chēng)-SAE-SAE名稱(chēng)-首次or隨訪+總結(jié)審查費(fèi)(受試者編號(hào))�����。 示例:015-HECB21003注射液-SAE-自發(fā)性腹膜炎-首次審查費(fèi)(S19005)��。 其中015(XXX)為項(xiàng)目院內(nèi)財(cái)務(wù)編號(hào) |
2 本中心遞交信(包括CRA TO PI及PI遞交部分)(簽字掃描版); +遞交信回執(zhí)(Word版?。?/span> | 遞交資料簡(jiǎn)述處:注明發(fā)生SAE受試者編號(hào)-SAE名稱(chēng)-首次or隨訪+總結(jié)?。 示例:SAE(S9005-自發(fā)性腹膜炎—首次) |
3 嚴(yán)重不良事件審查申請(qǐng)表 或 非預(yù)期不良事件審查申請(qǐng)表 | 模板請(qǐng)前往官網(wǎng)“文件下載”處下載 |
4 臨床試驗(yàn)嚴(yán)重不良事件報(bào)告表(申辦方模板) | 提供申辦方模板 |
5其他...... |
|
方案偏離與違背 | 1審查文件:方案偏離審查主審工作表(Word版����!) | 模板請(qǐng)前往官網(wǎng)“文件下載”處下載;填好表頭��,只需遞交Word電子版本���。 | XXX-試驗(yàn)藥品名稱(chēng)簡(jiǎn)稱(chēng)偏離審查費(fèi)(受試者編號(hào)) 示例:015-HECB21003注射液偏離審查費(fèi)(S9005�、S9007) 其中015(XXX)為項(xiàng)目院內(nèi)財(cái)務(wù)編號(hào) |
2 遞交信本中心遞交信(包括CRA TO PI及PI遞交部分)(簽字掃描版); +遞交信回執(zhí)(Word版?��。?/span> | 遞交資料簡(jiǎn)述處:注明發(fā)生偏離受試者編號(hào)���。 示例:偏離(S9005、S9007) |
3 方案偏離情況報(bào)告表 |
|
4 偏離情況詳細(xì)附表 | 需含有篩選號(hào)��、嚴(yán)重級(jí)別����、偏離簡(jiǎn)述��、處理措施��、結(jié)果等內(nèi)容。需PI及機(jī)構(gòu)質(zhì)控員簽字 |
5 年度/定期跟蹤��、偏離登記表 | 每次遞交需將之前遞交情況填寫(xiě)完整����; 模板請(qǐng)前往官網(wǎng)“文件下載”處下載 |
6其他...... |
|
年度/定期跟蹤審查 | 1 審查文件:年度定期跟蹤審查主審意見(jiàn)表(Word版!) | 模板請(qǐng)前往官網(wǎng)“文件下載”處下載�����;填好表頭�����,只需遞交Word電子版本�����。 | XXX-試驗(yàn)藥品名稱(chēng)簡(jiǎn)稱(chēng)-年度/定期跟蹤審查費(fèi)(審查年度起止日期) 示例:015-HECB21003注射液年度/定期跟蹤審查費(fèi)(2024.3.6——2025.3.5) 其中015(XXX)為項(xiàng)目院內(nèi)財(cái)務(wù)編號(hào) |
2 本中心遞交信(包括CRA TO PI及PI遞交部分)(簽字掃描版); +遞交信回執(zhí)(Word版?��。?/span> | 遞交資料簡(jiǎn)述處:注明審查年度起止日期�����。 示例:年度/定期跟蹤審查(2024.3.6——2025.3.5) 2024.3.6為初始審查批件簽發(fā)日期(若初審有復(fù)審則以復(fù)審批件簽發(fā)日期為準(zhǔn)) |
3 項(xiàng)目年度定期跟蹤審查研究進(jìn)展報(bào)告 |
|
4 年度定期跟蹤����、偏離登記表 |
|
5其他:...... |
|
結(jié)題審查 | 1審查文件:結(jié)題審查主審意見(jiàn)表(Word版!) |
|
|
2本中心遞交信(包括CRA TO PI及PI遞交部分)(簽字掃描版); +遞交信回執(zhí)(Word版?���。?/span> | 遞交資料簡(jiǎn)述處:注明項(xiàng)目在本中心起止日期。 示例:結(jié)題審查(2023.1.6——2025.3.5)�����。 2023.1.6為初始審查批件簽發(fā)日期(若初審有復(fù)審則以復(fù)審批件簽發(fā)日期為準(zhǔn)) | XXX-試驗(yàn)藥品名稱(chēng)簡(jiǎn)稱(chēng)-結(jié)題審查費(fèi)(項(xiàng)目在本中心起止日期) 示例:015-HECB21003注射液結(jié)題審查費(fèi)(2023.1.6——2025.3.5) |
3 結(jié)題審查申請(qǐng)表 |
|
|
4 臨床試驗(yàn)結(jié)題小結(jié)表(機(jī)構(gòu)辦同意結(jié)題簽字蓋章) |
|
|
5其他............ |
|
|
研發(fā)期間安全性更新報(bào)告 | 1本中心遞交信(包括CRA TO PI及PI遞交部分)(簽字掃描版); +遞交信回執(zhí)(Word版?��。?/span> | 一般每季度遞交一次 | 一般為備案 |
| 2.組長(zhǎng)單位同意備案回執(zhí) |
3 其他........ |
外院SUSAR | 1本中心遞交信(包括CRA TO PI及PI遞交部分)(簽字掃描版); +遞交信回執(zhí)(Word版?���。?/span> |
一般每季度遞交一次 |
一般為備案 |
| 2.組長(zhǎng)單位同意備案回執(zhí) |
| 3 其他........ |
其他 | 1本中心遞交信(包括CRA TO PI及PI遞交部分)(簽字掃描版); +遞交信回執(zhí)(Word版?��。?/span> |
| 一般為備案 |
2 其他......... |
|
三����、注意事項(xiàng)
(一) 本中心年度跟蹤審查頻率一般為12個(gè)月��,請(qǐng)?jiān)诰嚯x初始審查12個(gè)月之前的一個(gè)月內(nèi)遞交年度定期跟蹤審查����,初始審查日期以主委簽字時(shí)間為準(zhǔn)。
(二) 方案偏離/違背遞交頻率:經(jīng)研究者及申辦方判斷輕微方案偏離/違背每季度遞交一次�����,經(jīng)研究者及申辦方判斷重大偏離/違背自發(fā)現(xiàn)之日起立即遞交���。遞交頻率時(shí)間以初始審查批件日期為參照�。
(三)有關(guān)倫理問(wèn)題請(qǐng)咨詢(xún)衡陽(yáng)市中心醫(yī)院臨床試驗(yàn)倫理委員會(huì)秘書(shū):李德斌�����;電話:15211817561 �;微信:lidebin396917203。
本流程自2025年5月1日起實(shí)行
附件:最新?���。惱硐螺d模板(2025.5.1) 請(qǐng)使用本中心最新倫理附件模板?。?/strong>
 倫理資料模板下載2025.5.1.zip
倫理資料模板下載2025.5.1.zip
關(guān)于本中心倫理會(huì)議審查頻率的說(shuō)明:
本中心倫理會(huì)議時(shí)間以“高質(zhì)����、高效”為原則����,根據(jù)申辦方遞交資料進(jìn)度盡快安排具體上會(huì)時(shí)間��。通常在倫理辦公室接收電子版預(yù)審資料后1-2個(gè)工作日完成形式審查����,形式審查后立即協(xié)調(diào)會(huì)議時(shí)間,期間同步進(jìn)行主審委員預(yù)審���,會(huì)議時(shí)間通常在形式審查后一周左右�,具體會(huì)議時(shí)間跟CRA溝通協(xié)商后確定��。